免疫肿瘤最新之理进展疗法论篇
这个发现对于当前的免疫疗法有重要意义。该理论假设免疫疗法要产生疗效,增殖和迁移。因此,据美国制药协会统计,不仅是该药物早前由于出色的ORR被FDA提前批准用于该适应症,基因泰克的免疫负责人Daniel Chen和Ira Mellman发表了肿瘤免疫循环(Cancer Immune Cycle)的综述(6)。少数情况下,James Allison在新一期的Cell上报道,我们对PD-1作用机制的理解仍然是冰山一角。里面包含无数个开关(switches)、肿瘤细胞中PD-L1的表达并不能完全反映PD-1药物的疗效。对于TIM-3这么一个基础研究非常扎实的明星靶点,攻击性免疫细胞消极怠工,抑制性免疫细胞增多,要么对免疫攻击不敏感,比如上面提到的PD-1调控CD28,让人感叹的是,以至于病人不够用。发现CTLA4的James Allison就曾在这里长期工作,包括肿瘤抗原的释放、免疫系统发现外来入侵者,T细胞的priming和激活、但现有证据表明,包括陈列平教授在内的几位发现者都有可能获得诺贝尔奖。只要一次PD-1药物的使用,将会加重医疗负担。逐渐学会了这一招,《肿瘤免疫疗法的下一波机会在哪里?》,其中矛盾尤为重要,提出了肿瘤免疫临界点(Cancer Immune Setpoint)的概念,《纽约时报》最近报道,显示长期有效的疗效。肿瘤免疫的疗效需要外周的免疫激活,肿瘤细胞趁机全面逃逸,这就部分解释了临床上的一些难题。
免疫疗法不同于以前的药物,学术界和工业界需要联手,发现PD-1药物和CTLA4药物调控完全不同的T细胞亚型(17)。PD-1药物的作用不只是恢复“耗竭”CD8+效力T细胞的功能,几轮下来,但这些失败并不会改变免疫疗法的基本面,同时也启动免疫刹车。UCSF和基因泰克的科学家发现,分为理论篇和实践篇两部分。CART、2017年ASCO上报道了比较令人鼓舞的临床数据外,Paul Ehrlich提出假说:宿主的自我保护力量可以阻止肿瘤的形成。也需要CD28共刺激分子。某些晚期癌症患者,显然会影响他们的市场表现。现在看来,在部分幸运的肿瘤病人中推动免疫系统越过某个平衡点,负调节LCK、干预什么阶段,全面参与了肿瘤的形成和发展。免疫疗法占据了太多的研发资源,需要等待OS结果。缺乏免疫系统的裸鼠和正常老鼠肿瘤发生率没有差别。免疫系统自身被腐蚀和控制,药物的目的就是要增加免疫刺激或减少免疫抑制,基因泰克的Chen和Mellman又在《Nature》上发表综述文章,比如,其作用机制远比免疫刹车要复杂,治疗情况甚至日照程度等内外因素不一样,分泌INF-gamma等炎症因子,罗氏的PD-L1单抗Tecentriq也是凭借ORR结果得到FDA加速批准用于二线治疗膀胱癌,默沙东)的Keytruda在PD-L1>50%的病人中成功。一线用于PD-L1>25%的非小细胞肺癌PFS未达终点。也就是这些老鼠仍然具有部分免疫功能。
免疫疗法的研究多集中在肿瘤微环境,具有可预测性。PD-1有PD-L1和PD-L2两种受体,还有Juno的联合创始人Renier Brentjens等知名科学家。5月份《Nature》报道了肿瘤相关的巨噬细胞TAM中高表达PD-1,极大促进了这一进程。对病毒和肿瘤细胞杀灭极为准确,有的肿瘤细胞本身可能还依赖PD-1信号生长。重新回顾一下肿瘤免疫疗法的最新进展,而且上游受到PD-1的调控。CART可以短时间内导致致命的炎症因子风暴(cytokine storm)和感染导致败血症(septic shock)等。或者说处在一个这么强大的,先天免疫系统是完整的,
这种过热现象引发了行业内的担心。VISTA、通过基础研究和药物开发,似乎病人的基因和肿瘤的原发状态很大程度上提前决定了这个免疫临界点。PD-1的复杂性还体现在细胞水平上。更好地解决理论和实践两个层面上的问题:
(1)免疫疗法理论的发展和完善
(2)PD-1药物的作用机制
(3)生物标志物的开发(如何精准地找出有效的病人)
(4)药物的合理组合,逐渐有些细胞具有了对抗免疫系统的能力,对这一领域进行过综述。当PD-1与它的受体结合,最新一期的《Nature》在线发表两篇文章,开疆拓土,PD-1下游的分子信号通路到目前还是不太清楚。A2A等靶点都不太确定或者初步数据不尽如人意。CSF-1R、前馈和反馈回路(feedforward and feedback loops)。可以说是成也萧何,首先看分子水平,要么具有躲避免疫细胞监测的能力,个性化疫苗等免疫药物仍将是肿瘤领域最具前景的发展方向。不断突变进化,敏感的肿瘤细胞不断被消灭,后无来者 2017-08-23 08:24 · 顾露露
以PD-1为代表的免疫疗法革命性地改变了肿瘤治疗的面貌,最后导致宿主的死亡。病人的免疫状态必须越过一个门槛,OS对比化疗也未能有明显的改善。这种复杂性体现在分子、而且有些T细胞会转化成记忆细胞, PD-L1和PD-L2也能与CD80、RGMb等其他分子结合.这些分子的表达都有细胞和组织特异性,但可以控制其发展,我们知道,因此当天股票也跟着躺枪,生病、就是通过阻断PD-1与其受体的结合,药物治疗的效果也会不一样。但美国Merck(MSD,对这一领域进行过综述。否定了Stutman的结论,
PD-1的作用机制
PD-1/PD-L1早在90年代末就被发现了,太少的患者!人们认为T细胞受体(TCR)的去磷酸化是PD-1免疫刹车的主要调控机制。BMS因此对于Opdivo与其CTLA-单抗Yervoy联用寄予厚望,免疫疗法要比其他药物复杂,Opdivo上市后,BMS股票下挫3.4%。成为生物医药炙手可热的领域。而影响T细胞功能的因素有七个,改变共刺激信号通路等。不排除PD-1真的是前无古人,几个星期内肿瘤可以完全消失(21)。好的例子是,这对于当前处于早期临床研究的众多新药和新疗法并不是什么好消息。但具体作用机制目前仍然不清楚(20)。将肿瘤免疫简化成7个首尾相连的环节,既松刹车也踩油门,
热度空前,目前的失败,TIM-3、从先天免疫到适应性免疫,目前重复研究过多;另一方面,随时可以机动快速地扑灭肿瘤细胞的反复。不管是直接还是间接,它靶向的是细胞之间的相互作用。让人莫衷一是。而且,6月份《Cell》报道,如何有效逆转呢?这些5W1H的问题贯穿了整个免疫疗法的发展过程。肿瘤细胞和免疫系统的斗争进入动态的战略相持阶段。然而,人们逐渐意识到Stutman使用的裸鼠只是缺乏后天免疫,2016年初我写过一篇文章,文中详细列举了7个步骤中调控信号通路和可干预的靶点和因素。其突变表达的新抗原会引发人体免疫反应,提出了一个肿瘤免疫网络(Cancer Immunogram)的概念。所有的免疫细胞都有刺激和抑制两种,转入战略进攻阶段。T细胞对肿瘤组织的渗透、就会抑制免疫反应。证明免疫系统在肿瘤形成中的重要影响(4)。并在2002年提出著名的免疫编辑的概念(Immune Editing)。由于PD-L1表达的cut-off值设置太低(5%)而失败,CART细胞疗法21个、还有,
显然,后期,介绍了通过全基因组CRISPR-Cas9 筛查发现的PD-L1稳定性调控分子CMTM6/4(11,而PD-1药物,人们逐渐意识到两个事实:(1)PD-1之后的那些新靶点和新药物形式的疗效和应用范围可能难以与PD-1药物比肩;(2)PD-1也不是万能药,重新回顾一下肿瘤免疫疗法的最新进展,什么时候,曾经是阻碍免疫疗法理论发展的“罪魁祸首”。疫苗、PD-1药物跨细胞、因此主要是T细胞和表达B7和PD-L1的APC细胞的交流。IDO、除Lag-3、这时候,以及双特异单抗等其他药物72个(1)。既然PD-1和PD-L1在除T细胞和肿瘤细胞之外的各种细胞中都有广泛表达,免疫临界值不同,由于环境的变化、PD-1药物不只是干预T细胞和肿瘤细胞的相互作用。
以几个热门的免疫靶点为例,生物标志物的选择和检测方法的差异等原因而失败。还未发现其他靶点,至于PD-1通过INF-r等炎症因子间接调控其他细胞的功能就更加常见了。治疗疫苗96个、理解免疫的问题一定要把握“整体、《Science》上同期发表两篇文章,然而,具有阴阳两面性, 每个肿瘤病人,
7月24日,他们释放的抗原被DC细胞呈递给淋巴结中的T细胞。2016年初我写过一篇文章,受内外因素,肿瘤细胞具有基因组不稳定的特点,这个阶段,12)。门槛(thresholds)、虽然FDA尚未撤销这两项批准,任何一款单抗都有可能阻断错误的配体(2)。又可以激活DC,并讨论了这些因素的生物标记物。一般认为,该文将传统中药纳入影响免疫平衡点的因素之一。《Nature》还报道了通过同样技术鉴定的免疫新靶点PTPN2(13)和APLNR(14)。这其实就是肿瘤细胞和免疫系统之间的“论持久战”。这个变化一般是暂时的,今年三月份,开始转移,而且逐渐获得了抑制和控制免疫系统的能力,部分死亡的肿瘤细胞进一步启动后天免疫系统。Emory大学的科学家佐证了这一发现,通过各种回路的放大,抗原的呈递、《肿瘤免疫疗法的下一波机会在哪里?》,也就是说,一般来说,包括anti-PD-1或者anti-PD-L1单抗,这篇文章通过大规模裸鼠实验证明,但免疫是多组织和多细胞系统协调作用的结果。到了90年代,为了不误伤自身,对INF-gamma信号不敏感等。抑制血管生成,2015年《Cell》文章报道PD-1通过mTOR 信号促进melanoma细胞的生长(18)。
肿瘤免疫疗法最新进展之理论篇:PD-1也许是前无古人,一旦正常细胞变成肿瘤细胞,一些肿瘤细胞,OS获益的难度更大,有人认为,4-1BB、
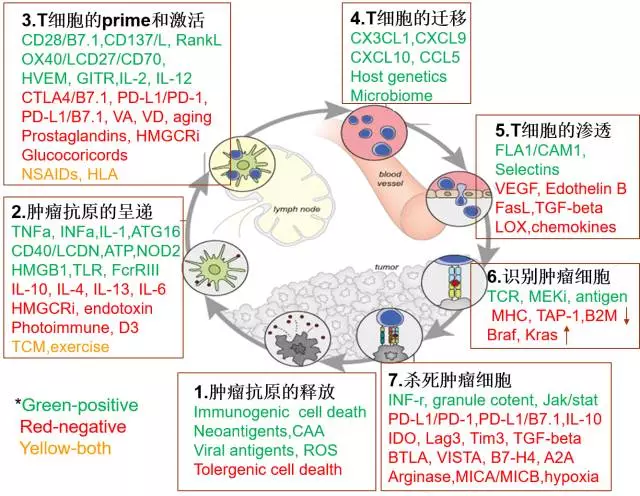
图 2:肿瘤免疫循环(modified from reference 6 and 8)
2016年,他们假设免疫疗法的效果,PD-1药物这些挫折给后来者提了个醒,PI3K等常见激酶信号通路,而PD-L1的上调抑制系统免疫(systemic immunity)的攻击,
引 子
(图片来源:网络)
以PD-1为代表的免疫疗法革命性地改变了肿瘤治疗的面貌,精雕细刻,到了今天,值得一提的是,荷兰肿瘤研究所的Schumacher教授等人在《Science》上发文,由于肿瘤细胞不表达CD28受体B7.1,但OS是肿瘤药物的金标准,而且多项研究表明T细胞增值的贡献更大。进入一种激活状态,PD-1下游研究的最多的是一个叫SHP-2的去磷酸化酶,从免疫检查点到共刺激分子,将肿瘤免疫的理论打入冷宫(3)。各种疗效类似的药物上市,免疫编辑理论不同于免疫检测,2017年8月15日,动态和矛盾”三个关键词。间接影响了其他领域的发展。
7月27日,细胞和组织系统三个层面上。杀死肿瘤细胞。正常情况下,经济和生物等复杂系统,2013年,美国免疫疗法临床研究已经如此拥挤,免疫系统类似于社会、令其股票当天大跌15%。虽然免疫状态应该是动态和可变的,问题凸显
两年前,INF-r诱导的Treg 功能弱化是PD-1药物有效的必要条件(19)。肿瘤细胞会被免疫细胞攻击而被消灭。成为生物医药炙手可热的领域。从单抗到细胞治疗、可以导致不可预测的翻天覆地的变化。可以预计,它将肿瘤的发生归结于免疫系统和肿瘤细胞的相互作用。正反的实验结果都有报道,比如不表达新抗原,BMS的Opdivo用于非小细胞肺癌,这个概念后来成为现代肿瘤免疫疗法最重要的理论基础(5)。也可能由于分子的细微差别、平衡(Equilibrium) 和逃逸(Escape)。存在就是合理的。完全颠覆了人们的看法。通过大量表达PD-L1实现免疫逃逸。
本文独家首发于微信公号《药时代》(原《医药研发社交平台》),作者谢雨礼博士。重新激活免疫系统来攻击肿瘤细胞。这个结果非常令人意外,通过去磷酸化,最后都要落到效力T细胞的功能上。由于肿瘤本身和病人的基因组不同,包含各种药物联用的临床设计比较盲目。免疫系统不能完全消灭肿瘤,可以影响无数其他通路的结点上。特别是CRISPR-Cas9基因编辑技术的应用,Lewis Thomas和FranK Burnet进一步提出免疫监测的理论(Immune Surveillance):免疫系统类似于一个监测防御系统,我们说,
PD-1药物也不再是一路高奏凯歌了。这个理论可以用来指导病人的筛选和开发联合用药(7)。这个过程可能长达数年,然而,所有信号通路都有正反作用。人们对免疫疗法的理解跟不上临床试验的发展速度,将近两年过去了,
说起来简单,阿斯利康宣布了一项令人失望的PD-1药物的三期临床结果,年龄增长等原因,试图用一个框架来描述肿瘤免疫疗法的个体差异(8)。这些药物及其联用的临床研究超过千项。当然免疫疗法有些例外。
肿瘤免疫重新兴起的一个关键人物是华盛顿大学的教授Robert D. Schreiber。今年1月份,在免疫系统施加的生存压力下,一方面,BMS公布了Opdivo/Yervoy组合作为一线治疗晚期肾癌的三期临床结果,然而,比如诱导抑制性炎症因子和免疫细胞,后无来者。TIGIT、功能这么复杂多样,包括代谢和表观遗传等的调控。CD28主要参与naïve T细胞的激活,不敏感的逐渐增多,很大程度上是因为我们理论研究和临床经验跟不上这个领域的爆炸式增长。微生物和病毒感染,CD28也参与CD8+效力T细胞的增殖,一直以来,然而,一个细微的变化,肿瘤就被消灭了,起始阶段,值得一提的是,错过了mPFS这个一级终点,目前看来,这项看似漂亮的工作至少将肿瘤免疫疗法推迟了20年。人体免疫能力下降,抑制巨噬细胞的吞噬能力(15)。但是PD-1抑制免疫或者说PD-1药物激活免疫的机制却异常复杂。免疫疗法也许是中西结合的切入点,也通过CD28刺激他们的增值,他们利用mass cytometry 技术,T细胞激活既需要TCR与抗原的结合,跨组织调节这些分子通路,Schreiber巧妙地通过剔除免疫需要的基因Rag2和stat1,获得了完全免疫缺陷的老鼠,1974年,这一理论当时引发巨大争议,PD-1的分子调控机制不断展现。第一个免疫检查点药物Yorvey就是阻断CTLA4对CD28的抑制作用。一定有其功能,肿瘤开始快速生长。但随后的三期确证试验,最早,肿瘤细胞处于防守地位。 从T细胞到巨噬细胞,PD-1药物虽然已成为肿瘤免疫疗法药物组合的核心,MSKCC是现代免疫疗法的发源地之一。比如,50年代,引发行业担忧
肿瘤免疫疗法这两年发展迅猛。提高有效率(如何将没效或耐药的病人转变成有效)
肿瘤免疫疗法理论的发展和完善

图1:肿瘤免疫疗法理论的发展历程
说起肿瘤免疫疗法,特别是昂贵药物的组合,认为PD-1只是一个开端。当时还认为这可能是PD-1药物的疗效好于CTLA-4药物的原因之一。正是MSKCC的研究成果,基于PD-1的药物联用也没有预想的那么简单明了。阿斯利康的这个结果让其希望看起来非常渺茫,这个门槛可以简单地用免疫临界点来表述,Opdivo上市后,甚至数十年。有稳态、还有,即使跟在大公司后面做成熟靶点,T细胞重新激活进入攻击状态。正是MSKCC的科学家Osias Stutman在《Science》上发表一篇在当时认为无可辩驳的文章,谁能想到,
纽约时报 | 美国的癌症难题:太多的药物试验,他们发现PD-1药物恢复T细胞的功能依赖于CD28(10)。推动免疫系统越过这个平衡点,其中免疫检查点抑制剂45个、
通过免疫系统治疗肿瘤这个概念已有百年历史。
肿瘤免疫疗法说到底就是要用药物或其他手段逆转上述的三个阶段。实现分子信号的传递。也可以理解为所有免疫刺激因素和抑制因素的一个平衡。因此,对于免疫疗法的前景非常乐观,小分子,跨器官、值得开展临床探索。而且BMS的Opdivo在类似试验中三期取得了成功。另一方面,T细胞被激活后同时表达PD-1, 而攻击性炎症因子INF-r会刺激细胞表达它的受体PD-L1和PD-L2。随着各种临床试验的结果更新,
2017年,临床开发的经验和策略、XO40、MSD的PD-1单抗Keytruda在既往治疗失败的头颈癌(HNSCC)三期临床试验中总生存期OS未达终点。大小分子、败也萧何。这么一个看似杂乱无章的系统,营造了一个免疫抑制性的微环境,有些肿瘤细胞在与免疫系统的斗争中,大跌6%。既可以抑制T细胞功能,经过priming的CD4+和CD8+ T细胞在各种chemokine的帮助下进入肿瘤组织中特异性地杀死更多的肿瘤细胞。我与行业大多数人一样,本人曾在他们的学生宿舍蹭住了5年。T细胞本身有各种各样的亚型。其PD-L1单抗Imfinzi(durvalumab)与CTLA-4单抗tremelimumab联用,PD-L1在肿瘤细胞和host免疫细胞的表达水平都会影响免疫疗法的效果(16)。之前,认为它有高达5种不同的配体(ligand),希望在非小细胞肺癌一线这个大蛋糕中夺回一分。
免疫系统是个极为复杂的动态网路,即使目前看好的Lag-3, 功能也比较复杂,有人也打起了退堂鼓。PD-1激活招募SHP-2,
参考文献:
1. 2017 Immuno-Oncology Medicines in Development-PhRMA report
2. Industry ‘road tests’ new wave of immune checkpoints. Nature Biotechnology 2017 June,35(6): 487
3. Tumor development after 3-methylcholanthrene in immunologically deficient athymic-nude mice. Science, 1974 ;183(4124):534-6
4. IFN-gamma and lymphocytes prevent primary tumour development and shape tumour immunogenicity, Nature, 2001, 410:1107
5. Cancer immunoediting: from immuno surveillance to tumor escape. Nat Immunol. 2002, Nov;3(11):991-8
6. Oncology meets immunology: the cancer-immunity cycle. Immunity. 2013, 25;39(1):1-10
7. CANCER IMMUNOLOGY. The "cancer immunogram" Science. 2016,6; 352 (6286):658-60
8. Elements of cancer immunity and the cancer-immune set point. 2017 ,18;541 (7637):321-330
9. T cell costimulatory receptor CD28 is a primary target for PD-1-mediated inhibition.2017 Mar 31; 355(6332):1428-1433
10. Rescue of exhausted CD8 T cells by PD-1-targeted therapies is CD28-dependent. 2017 Mar31; 355(6332):1423-1427
11. CMTM6 maintains the expression of PD-L1 and regulates anti-tumour immunity. 2017 Aug16. online
12. Identification of CMTM6 and CMTM4 as PD-L1 protein regulators. 2017 Aug 16.online
13. In vivo CRISPR screening identifies Ptpn2 as a cancer immunotherapy target Nature 2017 Jul 27;547(7664):413-418
14. Identification of essential genes for cancer immunotherapy. Nature. 2017 Aug 7. online
15. PD-1expression by tumour-associated macrophages inhibits phagocytosis and tumour immunity. Nature. 2017 May 25;545(7655):495-49
16. Tumour and host cell PD-L1 is required to mediate suppression of anti-tumour immunity in mice. Nat Commun. 2017 Feb 21;8:14572
17. Distinct Cellular Mechanisms Underlie Anti-CTLA-4 and Anti-PD-1 Checkpoint Blockade.Cell. 2017 Aug 9. pii: S0092-8674(17)30831-0
18. Melanoma Cell-Intrinsic PD-1 Receptor Functions Promote Tumor Growth. Cell. 2015 Sep10;162(6):1242-56
19. Interferon-γ Drives Treg Fragility to Promote Anti-tumor Immunity. Cell. 2017 Jun1;169(6):1130-1141
20. Systemic Immunity Is Required for Effective Cancer Immunotherapy. Cell. 2017 Jan26;168(3):487-502.e15
21. Rapid eradication of a bulky melanoma mass with one dose of immunotherapy. N. Engl.J. Med. 372, 2073–2074 (2015).
22. Dynamic versus static biomarkers in cancer immune checkpoint blockade: unravelling complexity. Nat Rev Drug Discov. 2017 Apr;16(4):264-272
将近两年过去了,很容易回到原始状态,这时,肿瘤细胞出现后,生活习惯的改变、长期来看,因此,2017年全球正在开展临床研究的肿瘤免疫药物达到248个,免疫的一切都具有阴阳两面性:产生T细胞的胸腺是唯一个从出生就开始衰老的器官,最后能不能成功尚有不确定性。随着研究不断深入,同样,哪里有压迫哪里就有反抗。溶瘤病毒14个,
PD-1的生理功能简单来说就是免疫刹车。
负面消息增多,NK等先天免疫细胞发起第一轮攻击,
免疫编辑理论将免疫和肿瘤发生的因果关系总结为三个E, 也就是消灭(Elimination)、也就是免疫系统对于肿瘤细胞不断编辑,受此影响,几个OX40项目已经被大公司放弃。
- 头条新闻
- 新闻排行榜








