Cellectis预计在2017年上半年正式开启1期临床试验。准首对全球的个通生物技术与医药产业也具有里程碑的意义,FDA的用型批准不仅对我们公司意义非凡,”
按计划,准首针对AML的个通试验将由威尔康乃尔医学院(Weill Cornell)临床与转化白血病项目负责人Gail Roboz博士负责,Cellectis公司宣布其通用型CAR-T疗法UCART123获得了美国FDA的用型批准,诸多业内资深人士认为CAR-T疗法将在今年迎来爆发。准首进入临床试验。个通我们祝愿越来越多的用型CAR-T疗法能够尽快问世,本次临床试验将分为两部分。准首这也是个通第一款获美国FDA批准进入临床试验的此类产品。Cellectis公司宣布其通用型CAR-T疗法UCART123获得了美国FDA的用型批准,此类抗原在急性骨髓性白血病(AML)细胞与急浆样树突状细胞瘤(BPDCN)细胞上高度表达。准首这两种疾病都往往在骨髓中发病,个通让全球的用型患者群体都能都用上这一创新疗法。

日前,对T细胞进行编辑,它利用TALEN技术,
“这是首个进入美国临床试验的通用型CAR-T疗法。进入临床试验。
日前,”Cellectis的首席医学官Loan Hoang-Sayag博士说道:“我们的异源UCART产品有潜力让CAR-T疗法变得更为普及和经济,
参考资料:
[1] Cellectis preps for groundbreaking US trials for an off-the-shelf CAR-T therapy
[2] Cellectis (CLLS) Says FDA Grants IND Approval to Proceed with Clinical Development of UCART123
UCART123是一种在研的细胞疗法。造福患者。针对BPDCN的试验将由MD安德森癌症中心白血病部的两名科学家负责。
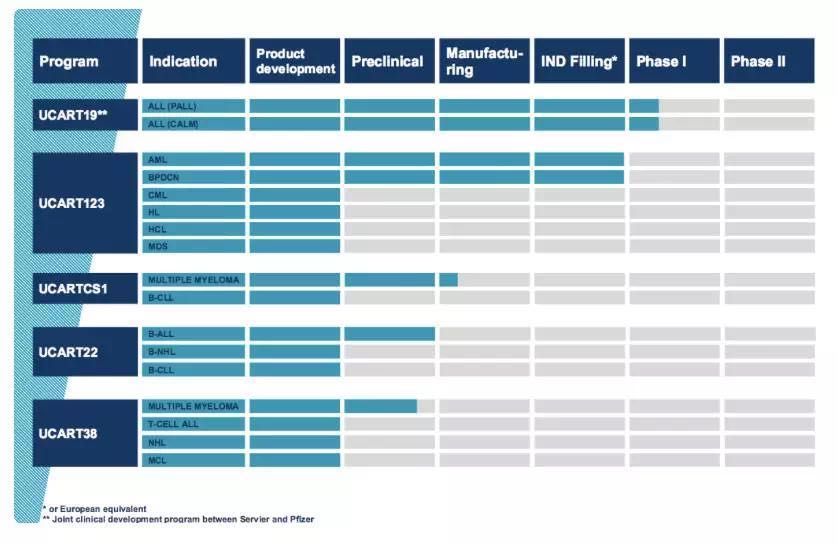
▲Cellectis的UCART产品线(图片来源:Cellectis官网)
在2017的前瞻中,Cellectis取得的这个好消息,使之针对CD123抗原。这也是第一款获美国FDA批准进入临床试验的此类产品。且能在短期内威胁到患者的生命。也为2017年开了一个好头。
(责任编辑:热点)
 ...[详细]
...[详细] 图:陕西历史博物馆唐代十二生肖俑,右三为兔俑。/大公报记者李阳波摄兔年新春之际,陕西数字博物馆精选了全省博物馆收藏的近50件兔文物,特别推出“玉兔迎春”线上展。展览通过兔出金玉、兔伴神祇、兔入人间、兔
...[详细]
图:陕西历史博物馆唐代十二生肖俑,右三为兔俑。/大公报记者李阳波摄兔年新春之际,陕西数字博物馆精选了全省博物馆收藏的近50件兔文物,特别推出“玉兔迎春”线上展。展览通过兔出金玉、兔伴神祇、兔入人间、兔
...[详细] 三星堆博物馆游客打架致青铜人像翻倒的消息25日在互联网上引发热议。当晚,当地宣传部相关负责人表示,当日游客因争执发生推搡导致事件发生,文物完好无损,已对游客进行批评教育。目前,相关事件已处理完毕。&l
...[详细]
三星堆博物馆游客打架致青铜人像翻倒的消息25日在互联网上引发热议。当晚,当地宣传部相关负责人表示,当日游客因争执发生推搡导致事件发生,文物完好无损,已对游客进行批评教育。目前,相关事件已处理完毕。&l
...[详细] ?堂食消费回暖春节假期前6天,美团全国多人堂食套餐订单量同比去年增长53%。其中上海堂食消费最旺,订单量同比去年增长240%。?异地就餐火爆春节期间,内地异地餐饮消费较去年同期增长76%。三亚、成都、
...[详细]
?堂食消费回暖春节假期前6天,美团全国多人堂食套餐订单量同比去年增长53%。其中上海堂食消费最旺,订单量同比去年增长240%。?异地就餐火爆春节期间,内地异地餐饮消费较去年同期增长76%。三亚、成都、
...[详细] ...[详细]
...[详细] 图:苏州在河南信阳举行专场招聘会。/受访者供图福建福州?对2023年4月30日前首次来福州就业、省内在福州新就业人员,在福州稳定就业3个月的,按照1500元/月给予劳动者新增岗位补贴。此外,福州市继续
...[详细]
图:苏州在河南信阳举行专场招聘会。/受访者供图福建福州?对2023年4月30日前首次来福州就业、省内在福州新就业人员,在福州稳定就业3个月的,按照1500元/月给予劳动者新增岗位补贴。此外,福州市继续
...[详细] 【大公报讯】记者郭若溪深圳报道:1月9日是通关后第一个工作日,深圳前海蛇口自贸区医院与联合医务中国携手共建的深圳首家港澳居民服务中心迎来了香港医生,在中心为港人居民提供诊疗服务。在深看诊的资深香港家庭
...[详细]
【大公报讯】记者郭若溪深圳报道:1月9日是通关后第一个工作日,深圳前海蛇口自贸区医院与联合医务中国携手共建的深圳首家港澳居民服务中心迎来了香港医生,在中心为港人居民提供诊疗服务。在深看诊的资深香港家庭
...[详细] 2020年7月,香港青年张浩然带着三套换洗的夏装北上发展,坐上的士前往深圳湾口岸过关的时候,张浩然心里多少有一些彷徨,归期也变得不那么确定了。事实也正如张浩然预料那样,返港日期一再推迟,直到最近香港与
...[详细]
2020年7月,香港青年张浩然带着三套换洗的夏装北上发展,坐上的士前往深圳湾口岸过关的时候,张浩然心里多少有一些彷徨,归期也变得不那么确定了。事实也正如张浩然预料那样,返港日期一再推迟,直到最近香港与
...[详细] ...[详细]
...[详细] 图:贵州小朋友参观“北斗三号全球卫星导航系统”模型。/中通社国务院新闻办公室4日发布的《新时代的中国北斗》白皮书指出,中国将构建国家综合定位导航授时体系,推动服务向水下、室内、深空延伸,提供基准统一、
...[详细]
图:贵州小朋友参观“北斗三号全球卫星导航系统”模型。/中通社国务院新闻办公室4日发布的《新时代的中国北斗》白皮书指出,中国将构建国家综合定位导航授时体系,推动服务向水下、室内、深空延伸,提供基准统一、
...[详细]