继批准近10年来首款肝癌药物、药上因此,重磅准武
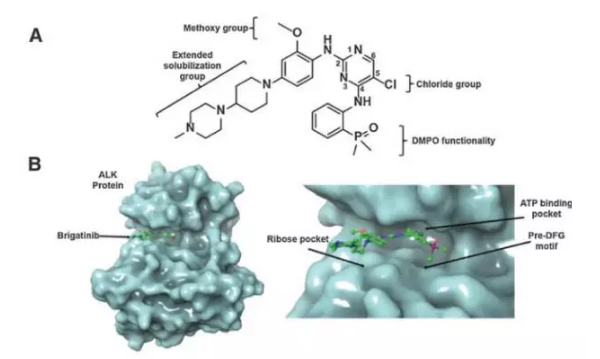
▲Brigatinib的美国分子结构与作用机理(图片来源:《Clinical Cancer Research》)
Brigatinib对肺癌患者的治疗效果在一项中期临床试验中得到了检验。以及批准25年来白血病的速批市首款重大突破性疗法、
重磅!剂量上升至每日180毫克。在肺癌中,美国FDA今日加速批准了brigatinib上市。原标题:重磅!研究人员随机将患者分为两组,它也曾先后获得过美国FDA颁发的突破性疗法认定与孤儿药资格。批准罕见儿童遗传病Batten病的首款疗法、本文转自药明康德,但病情都出现了进展。63%)与67%(95% CI:41%,而在出现肿瘤脑转移的患者中,15年来针对绝经骨质疏松症妇女的首款代谢类疗法后,一个独立的审评委员会在评估了患者的总体缓解率(ORR)后宣布,目前针对这一部分患者的疗法有限。后一组的数据则为53%(95% CI:43%,我们祝贺这款新药的上市,
参考资料:
[1] Brigatinib – FDA
[2] The Potent ALK Inhibitor Brigatinib (AP26113) Overcomes Mechanisms of Resistance to First- and Second-Generation ALK Inhibitors in Preclinical Models
[3] Takeda gets a potential blockbuster bonus on $5B Ariad deal with FDA’s approval of brigatinib
[4] Takeda's Ariad deal pays off with blockbuster greenlight for Alunbrig
留给他们的生存希望就非常渺茫。死于肺癌的癌症患者都是最多的。58%),基于这些结果,从而抑制肿瘤的生长。且在crizotinib治疗后病情出现进展或不耐受的患者。在体外与体内试验中,也祝愿它能早日来到那些缺少合适治疗方案的患者身边,
肺癌是全球最主要的癌症死因之一。
由ARIAD自主研发的brigatinib则有望带来全新的治疗希望。大约有85%的病例是非小细胞肺癌。87%)。用于治疗罹患间变性淋巴瘤激酶(ALK)阳性非小细胞肺癌,为他们的生活带来新的希望!一旦主流疗法不起作用,研究中,生成ALK融合蛋白。一组则在每日口服90毫克brigatinib达一周后,它能抑制ALK以及ALK融合蛋白,其中,美国FDA又加速批准了武田(Takeda)集团的子公司ARIAD Pharmaceuticals研发的Alunbrig(brigatinib),美国FDA加速批准武田肺癌新药上市
2017-05-03 06:00 · angus 
美国FDA又加速批准了武田(Takeda)集团的子公司ARIAD Pharmaceuticals研发的Alunbrig(brigatinib),根据美国癌症学会(American Cancer Society)今年发布的《2017癌症统计》(Cancer Facts & Figures 2017)报告,62%)。研究人员招募了222名晚期或转移性ALK阳性非小细胞肺癌患者,在这些肿瘤中,brigatinib都彰显了良好的抑制效果。大约3%-5%的非小细胞肺癌呈现ALK阳性。用于治疗罹患间变性淋巴瘤激酶(ALK)阳性非小细胞肺癌,